L'énergie interne
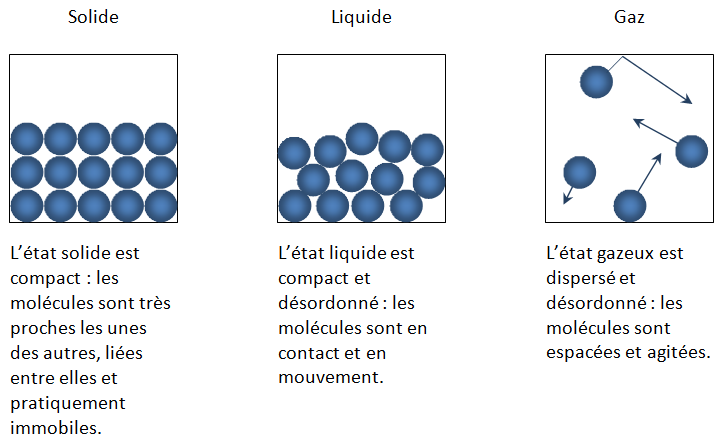
I - Les états physiques de la matière
⇨ Les propriétés macroscopiques de la matière dépendent de la température. Par exemple l'état physique. Au niveau microscopique, cela se traduit par des interactions entre les particules, par la posibilité ou l'impossibilité des particules à se déplacer...
II - Température
⇨ La température d'un corps traduit l'agitation interne de ses constituants miscroscopiques (atomes, molécules, etc.). Plus les particules sont agitées, plus la température est élevée. La température est une mesure de l'agitation thermique microscopique.
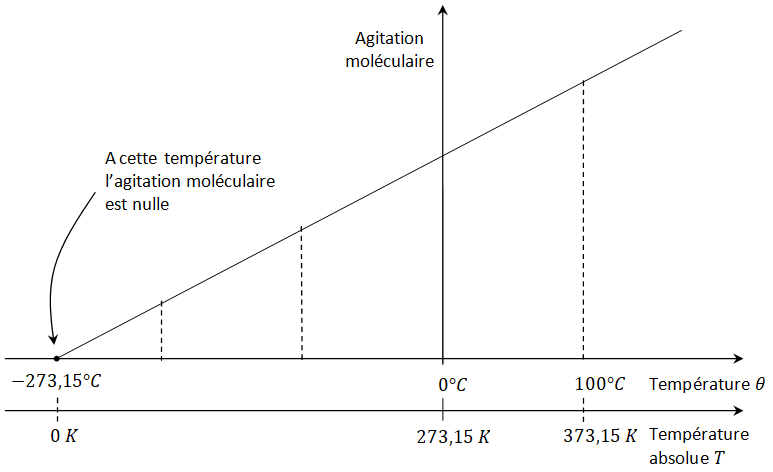
⇨ Il existe plusieurs échelles de température :
- l'échelle du système international (SI) qui utilise le kelvin. on note T la température lorsqu'elle est exprimée en kelvin ;
- une échelle courante qui utilise le degré Celsius. on note θ la température lorsqu'elle est exprimée en degré Celsius.
⇨ La température thermodynamique absolue \(T\) (K) se calcule à partir de la température \(θ\) exprimée en degrés Celsius (°C) par la relation :
\[ \bbox[yellow, 4px, border:1px solid red] { T = θ + 273,15 } \]⇨ Les écarts de température exprimés en kelvin ou en degrés Celsius sont identiques :
\[ \bbox[yellow, 4px, border:1px solid red] { ΔT = Δθ } \]⇨ Une température se mesure à l'aide d'un thermomètre. Il existe différentes techniques utilisées, qui sont toutes basées sur les modifications d'une grandeurs physique du matériau utilisé:
- thermomètre à alcool : dilatation de l'alcool ;
- thermomètre électronique : résistance électrique (CTN, CTP, thermistance, résistance de platine) ;
- thermomètre infrarouge : mesure du rayonnement de la surface d'un corps.
III - Énergie interne d’un système
⇨ L'énegie interne, notée \(U\), est indépendante de la vitesse (énergie cinétique du système) ou de la position (énergie potentielle du système).
⇨ L'énergie interne est l'énergie accumulée par les particules qui constituent le système.
⇨ On distingue trois contributions à l'énergie interne :
- L'agitation moléculaire : énergie cinétique liée au mouvement des particules.
- L'énergie de cohésion des particules : énergie potentielle d'interaction intermoléculaire responsable de la forme d'un solide ou d'un liquide. (interaction de van der Waals, liaisons hydrogène)
- L'énergie de liaison moléculaire et atomique au sein des particules : énergie potentielle d'interaction intramoléculaire. (liaison covalente, liaison ionique)
⇨ La variation d'énergie interne \(ΔU\) peut avoir deux origines :
- Le travail \(W\) d'une action qu'on excerce sur le système : déformation (compression, dilatation/détente), usinage (ajout ou perte de matière)
- Un transfert d'énergie thermique \(Q\) qui s'accompagne soit d'une variation de température, soit d'un changement d'état.
Remarque. Dans les cas de figures que nous rencontrerons, généralement \(W=0\). Le système ne subira aucune déformation.
Note. L'énergie interne est une grandeur fondamentale de la thermodynamique dont le sujet d'étude est le lien entre la mécanique (le travail) et les phénomènes de tranferts thermiques.
IV - Transfert thermique accompagné d'une variation de température (\(ΔT \neq 0\))
⇨ Dans ce cas de figure la température du système évolue, l'agitation moléculaire, l'énergie cinétique des particules est la contribution à la variation de l'énergie interne du système.
\[ \bbox[yellow, 4px, border:1px solid red] { Q=m × C × ΔT } \]- \(Q\) : quantité d'énegie thermique (en \(J\)) ;
- \(m\) : masse du système (en \(kg\)) ;
- \(C\) : capacité thermique massique (en \(J.kg^{-1}.°C^{-1}\) ou en \(J.kg^{-1}.K^{-1}\)) ;
- \(ΔT\) : variation de température du système (en \(°C\) ou en \(K\)).
⇨ La capacité thermique massique d'un matériau représente la quantité d'énergie qu'il faut fournir pour élever la température d'un kilogramme de ce matériau d'un Kelvin (ou d'un degré Celsius).
Remarque. \(ΔT = T_f - T_i\). Par conséquent, si \( ΔT<0 \) alors \(T_f < T_i\), c'est-à-dire que la température décroît. Le système se refroidit, il perd de l'énergie thermique.
V - Transfert thermique accompagné d'un changement d’état (\(ΔT = 0\))
⇨ La courbe de température du changement d’état en fonction du temps de l’eau de solide à liquide présente un palier : la température reste constante tout au long du changement d’état.
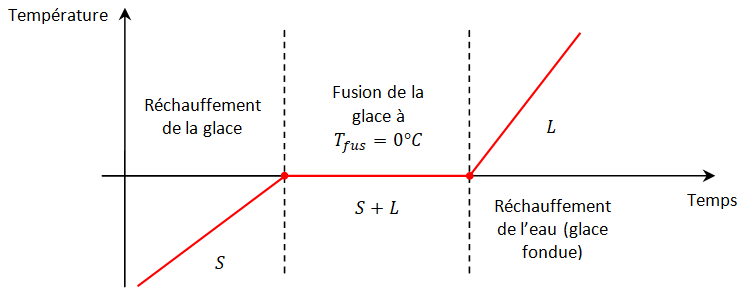
⇨ L’énergie apportée est utilisée pour rompre la cohésion entre les molécules d’eau. Elles sont ordonnées à l’état solide et dispersées à l’état liquide.
⇨ La quantité d'énergie \(Q\) mise en jeu est donnée par la relation :
\[ \bbox[yellow, 4px, border:1px solid red] { Q=m × L } \]- \(Q\) : quantité d'énegie thermique (en \(J\)) ;
- \(m\) : masse du système (en \(kg\)) ;
- \(L\) : chaleur latente de changement d'état (en \(J.kg^{-1}\) ;
VI - Les différents modes de transferts thermiques : conduction, convection, rayonnement.
⇨ Un transfert thermique s'effectue toujours des zones les plus chaudes vers les zones les moins chaudes.
⇨ En l'absence d'apport extérieur d'énergie, deux corps de températures différentes forment un système au sein duquel il se produit des échanges d'énergie thermique. La température de chacun des deux corps va évoluer jusqu'à être égales. On dit alors que les deux corps sont à l'équilibre thermique.
⇨ Il existe trois modes de transfert thermique :
| Tranfert par... | Description |
|---|---|
| Conduction | les deux corps sont en contact et immobiles |
| Convection | les deux corps sont en contact mais au moins l'un des deux est en mouvement |
| Rayonnement | les deux corps ne sont pas en contact, le transfert a lieu à distance. |


